“Перфторан” революционная комбинация
В первых опытах на крысах было наглядно продемонстрировано влияние эмульсий перфторуглеводородов на метаболизм NO: при введении “Перфторана” наблюдались предсказанные колебания концентраций нитрита и нитрата в плазме, изменения частоты сердечных сокращений, обычные при действии вазодилаторов типа нитроглицерина. Ингибирование NO-синтаз снимало эти эффекты [6]. Несколько лет спустя эту работу повторили в США [7].
Побочные эффекты применения кровезаменителей типа “Перфторан” во многих случаях проявлялись не сразу, а спустя значительное время после переливания крови. Поверхностно-активные вещества, используемые для стабилизации эмульсий при создании ПФУ-кровезаменителей, выводятся из организма гораздо быстрее, чем сами ПФУ (характерные времена - сутки и месяц соответственно). Если в первые часы после введения эмульсия становится основным местом окисления NO, то через сутки процессы перемещаются главным образом в естественные липидные фазы организма, в которых растворились ПФУ. Ясно, что в организме они (в виде отдельной фазы или растворенные в имеющихся гидрофобных фазах) будут влиять не только на параметры мицеллярного окисления NO из-за роста QO2 и, особенно, QNO, но и на все последующие процессы, включая нитрование и нитрозирование липидов, белков и нуклеиновых кислот. Таким образом, “отравления” под действием химически инертных перфторуглеводородов, в том числе газообразных, растворяющихся в липидах, можно объяснить потерей устойчивости системы регуляции метаболизма оксидов азота.
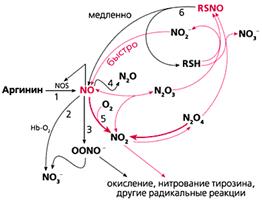
Рис.1. Схема биосинтеза NO и основные метаболические пути оксидов азота.
Ускорение окисления NO кислородом отражается на равновесии высших оксидов азота; при этом их стационарные концентрации меняются. Если электрофильное нитрозилирование (образование RSNO, рис.1) преимущественно протекает под действием NO+ (N2O3, N2O4), а радикальные реакции (включая нитрование и окисление белков и нуклеиновых кислот) - под действием ·NO2, то при использовании искусственных гидрофобных фаз в качестве кровезаменителей желательно сместить равновесие в сторону первых, во всяком случае не увеличивать стационарные концентрации NO2.
Концентрации высших оксидов азота при окислении NO чрезвычайно низки, и измерить их обычными методами не удается. Мы нашли простой и чувствительный способ, основанный на определении нитрата в продуктах окисления. Нитрат восстанавливается в нитрит соединениями ванадия, скорость этого процесса измеряют с помощью реакции Грисса (по образованию красителя). Если из образца удалить имевшийся первоначально (до восстановления нитрата) нитрит, весь образовавшийся краситель будет происходить из нитрата. Поскольку в результате гидролиза N2O3 получается только нитрит
N2O3 + H2O = 2HNO2, (1)
а при гидролизе N2O4 - эквимолярная смесь нитрита и нитрата
N2O4 + H2O = HNO2 + HNO3, (2)
доля нитрата в продуктах будет мерой стационарных концентраций обоих оксидов. В целом, в малополярных гидрофобных фазах стабилизация N2O3 при сольватации минимальна, распад на NO и NO2 усиливается, и доля NO2 должна расти:
NO2 + NO = N2O3. (3)
Анализ системы уравнений для стационарных концентраций оксидов азота показал, что возможно снижение [NO2]ст независимо от изменений [NO]ст и общего пула оксидов азота [8]. В частности, избирательно ускоряя нитрозилирование, мы снижаем не только [N2O3]ст, но и [NO2]ст, т.е. скорости всех радикальных реакций с его участием. В этой связи поиск катализаторов нитрозилирования/денитрозилирования становится важной задачей биохимии.
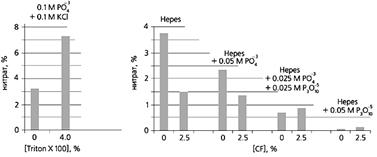
Рис.2. Гистограмма, отражающая вклад гетерогенности среды и катализаторов денитрозирования в баланс нитрит/нитрат при окислении NO. Слева: в гетерогенной среде скорость окисления NO выше, чем в гомогенной. Обычно система равновесий высших оксидов азота сдвигается в сторону NO2 и N2O4, и доля нитрата в продуктах возрастает. Triton X 100 - детергент (аналог мыла), использованный для получения липосом (по данным Liu et al., 1998). Справа: хотя в CF-эмульсиях скорость окисления NO возрастает сильнее, чем в обычных липидах, сольватация и скорости гидролиза высших оксидов азота изменены. В присутствии “Перфторана” доля нитрата в продуктах ниже, чем в гомогенном водном растворе (левая пара столбиков). Фосфат (PO4– 3 ), пиро- (P2O7–4 ) и триполифосфат (P3O10–5 ) ускоряют гидролиз N2O3 в нитрит. В результате стационарные концентрации NO2 и N2O4 уменьшаются и выход нитрата падает. Видно, что полифосфат гораздо активнее, чем фосфат. Hepes - компонент буферного раствора.
Другое по технологическим наукам
Основоположник современной радиотехники и радиоэлектроники
Галилей и
Ньютон заложили основы механической картины мира,Фарадей и Максвелл – основы
электромагнитной картины.
А. Эйнштейн
Часть 1.
В 1901 г.
ведущий американский электротехнический журнал Electrical World and Engineer
опубликовал результаты своеобразного конкурса, организованного в озн ...